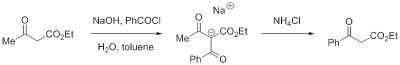 Начать я решил с бензоилуксусного эфира. Перегнанные исходники (ацетоуксусный эфир и бензоил хлорид) были любезно предоставлены кузнецовскими ребятами, «фракции нефти, кипящие при 95-110 °С», были успешно заменены толуолом, а вот 33% гидроксид натрия уж пришлось готовить самому. Единственное надо было найти толстостенную колбу (разогрев при растворении твердой щелочи нехилый) и не держать раствор долго в стеклянной посуде. Я, если честно, обрадовался, что мне не надо работать с металлическим натрием. Он, конечно, не взорвался бы, но чем проще реактив в обращении, тем больше я к нему предрасположен. Первоначально меня смутило работать с бензоил хлоридом. И дело не в специфическом запахе ацил хлоридов (нюхали в лабе и не такое), а в том, что я считал эти вещества неустойчивыми и гидролизующимися на воздухе, а тут предстояло смешивать его с водным раствором. Но МАК развеял этот миф, напомнив про условия ацилирования по Шоттену–Бауманну. Реакция проводилась в трехгорлой колбе. В два горла были вставлены капельные воронки, а что в третье? Посмотрел методику в OrgSyn. Должна быть механическая мешалка, значит, она и была. Практикум был, пожалуй единственным местом, где я использовал этих монстров, грозящих разнести колбу, стоит только подсоединить их напрямую в розетку. Неприятности начались с самого начала. Только я приоткрыл краники, и хлорид с щелочью стали равномерно прикапываться к ацетоуксусному эфиру в толуоле, как эти краники потекли (а я их проверял!). А времени уже было часов пять. Стоило ли начинать синтез так поздно, когда начало предвещает определенные мучения. Михаил Анатольевич справедливо отметил, что решать мне и никому больше. И я решил синтезировать.
Начать я решил с бензоилуксусного эфира. Перегнанные исходники (ацетоуксусный эфир и бензоил хлорид) были любезно предоставлены кузнецовскими ребятами, «фракции нефти, кипящие при 95-110 °С», были успешно заменены толуолом, а вот 33% гидроксид натрия уж пришлось готовить самому. Единственное надо было найти толстостенную колбу (разогрев при растворении твердой щелочи нехилый) и не держать раствор долго в стеклянной посуде. Я, если честно, обрадовался, что мне не надо работать с металлическим натрием. Он, конечно, не взорвался бы, но чем проще реактив в обращении, тем больше я к нему предрасположен. Первоначально меня смутило работать с бензоил хлоридом. И дело не в специфическом запахе ацил хлоридов (нюхали в лабе и не такое), а в том, что я считал эти вещества неустойчивыми и гидролизующимися на воздухе, а тут предстояло смешивать его с водным раствором. Но МАК развеял этот миф, напомнив про условия ацилирования по Шоттену–Бауманну. Реакция проводилась в трехгорлой колбе. В два горла были вставлены капельные воронки, а что в третье? Посмотрел методику в OrgSyn. Должна быть механическая мешалка, значит, она и была. Практикум был, пожалуй единственным местом, где я использовал этих монстров, грозящих разнести колбу, стоит только подсоединить их напрямую в розетку. Неприятности начались с самого начала. Только я приоткрыл краники, и хлорид с щелочью стали равномерно прикапываться к ацетоуксусному эфиру в толуоле, как эти краники потекли (а я их проверял!). А времени уже было часов пять. Стоило ли начинать синтез так поздно, когда начало предвещает определенные мучения. Михаил Анатольевич справедливо отметил, что решать мне и никому больше. И я решил синтезировать.Кое-как сладил с кранами, довел реакцию до конца, отделил нужный мне желтый водный слой (именно там сидела соль промежуточного трикарбонильного соединения) и засыпал его хлоридом аммония. На следующий день, то есть в какой-то четверг, я провел необходимые экстракции и продукт предстояло перегнать в вакууме. Так как это был не совсем практикумовский синтез, то мне не пришлось ждать, когда сжалится водоструй. Я взял мой продукт в кузнецовскую лабу, где с помощью Олега (или, что вернее описывает процесс, Олег с моим участием) продукт был перегнан в вакууме масляного насоса. Были собраны три фракции различного желтоватого оттенка, но их судьба меня не сильно заботила, так как на этом моя скромная роль себя исчерпала. По слухам, вещество оказалось не достаточно чистым по ЯМР и его перегоняли еще раз, но значительная доля енольной формы (как цис-, так и транс-) усложняла спектр и требовала определенной осторожности при его интерпретации. Но это были не мои хлопоты, мой отчет к тому времени был давно принят.
Следующая станция «Фридель–Крафтс».
Алексей Геннадьевич выдает мне гетероциклический исходник, янтарный ангидрид и безводный хлорид алюминия. Последний закрыт в стаканчике полиэтиленом. Методику я сам искал по книжкам. Нашел схожие реакции в Органикуме и Титце. В одной из них растворителем был нитробензол, но наш лаборант справедливо рассудил, что избавиться от него нам удастся только отгонкой с паром, и мы использовали... Я не помню, что мы использовали. Опять CCl4? В общем, это не так уж важно. Вновь была задействована механическая мешалка.
Оставив черную реакционную смесь с образовавшимся красным комплексом доходить до ума, я приступил к Гриньяру.
Это был первый Гриньяр в моей жизни, и работа казалась мне очень ответственной, так как сами магний-органические соединения так и норовят как-нибудь испортиться. Недаром, лаборант выдавал особый безводный эфир. Сама реакция между магнием и этилбромидом завелась с пол-оборота безо всякого дополнительного инициатора (EtBr сам себе инициатор).
И пока магниевая стружка растворялась, я пошел понаблюдать своего Фриделя, а также поделать кое-какие другие дела. Но когда я вернулся к Гриньяру, то к своему ужасу обнаружил, что в моей колбе сухо: весь растворитель куда-то делся (улетел твой эфир через затвор мешалки, или ты не закрыл кран и саму капельную воронку). Стенки покрыл белый налет этилмагний бромида или того, во что он превратился. Неужели переделывать? Хорошо, что это было только начало синтеза. Иногда забывчивость при экстракции приводит к тому, что приходится экстрагировать штатив хлористым метиленом. А в моем случае руководство лишь сказало добавить новую порцию эфира и продолжать, то есть прикапывать ацетон. Чудом или по законам химии, но Гриньяр не заметил потери растворителя, и трет-амиловый спирт был в конце концов получен с выходом 105% от методики. Дополнительной тонкостью при работе с третичным спиртом было подкисление хлоридом аммония, а не более сильной кислотой. Ну, а перегонка под атмосферным давлением стала для меня рутинной.
Надо ли говорить, что с сукцинированием дела обстояли не столь радужно. Память моя отказывает воскрешать подробности обработки реакционной смеси, но я твердо помню, что в очередной раз получив ерунду, Алексей Геннадьевич решил приберечь свой исходник, и МАК назначил мне новый субстрат – толуол.
Его реакция с янтарным ангидридом описана в Титце и является первым шагом к декалоновой системе. Мне оставалось только воспроизвести ту методику, дабы доказать, что причина провалов не в моих руках, голове или ДНК, а в присущем химии сопротивлению неизведанному. Не буду скромен, после перекристаллизации из бензола белые кристаллы продукта были получены с точно таким же выходом и т.пл., какие привели Титце и Айхер. А что другого можно ожидать от относительно (по сравнению, например, с бензолом) реакционноспособного толуола, который к тому же используется как растворитель? Оставалось только вымыть посуду, чтобы под занавес грохнуть на счастье стакан на 250 мл. Но это ерунда: штрафов в виде пачек с порошком и содой, накладывавшихся лаборантом за разбитую ценную посуду типа трехгорлых колб и шариковых холодильников, я избежал.
Последнее вещество я сдал 13 апреля, но реально практикум для меня закончился неделей раньше, так как отфильтровать и взвесить кристаллы – формальность, а не полноценный рабочий день. Мои однокурсники, кто сидел на пятках, а кто застрял во втором коллоквиуме. Им еще предстоял трехстадийный контрольный синтез, ради которого в конце апреля практикум переехал в лабы Михаила Анатольевича и Алексея Геннадьевича. Но меня тот период не касался, так как свой синтез я предполагал сделать в лабе. А это уже часть другой не менее длинной саги под титлом «Бетулин». Не буду врать, трех стадий я тогда так и не сделал, что, правда, не помешало мне выдумать спектр для последнего соединения, написать литобзор по перегруппировке Бекмана, доложиться и, в конце концов, получить зачет по практикуму.
А чем вам запомнился наш замечательный практикум по органической химии?


